Sisällysluettelo
Ionisidokset ja ioniyhdisteet
Tiivistelmä
- Atomit muodostavat keskenään sidoksia ja syntyy yhdisteitä
- Kemiallisen sidoksen tyypit ovat ionisidos, kovalenttinen sidos ja metallisidos
- Ionisidos muodostuu, kun metalli ja epämetalli reagoivat keskenään
- Vetovoima negatiivisesti varautuneen metallin ja positiivisesti varautuneen epämetallin välillä
- Ionisidoksellista yhdistettä kutsutaan suolaksi
- Epämetallien reagoidessa keskenään syntyy molekyyli, jossa on kovalenttinen sidos.
- Kovalenttisessa sidoksessa atomeilla on yhteisiä elektroneja
Atomit ovat vain harvoin yksin. Ylivoimaisesti suurin osa atomeista on jatkuvasti sitoutuneena muihin atomeihin. Mitä tämä tarkoittaa ja mistä se johtuu?
Oktetti
Aiemmin opit, että atomissa elektroneja on yhtä monta kuin protonia. Tällöin sanotaan, että atomi on perustilassaan: protonien positiivinen varaus ja elektronien negatiivinen varaus kumoavat toisensa. Tämä ei kuitenkaan ole atomeille mieluisin tila. Kaikki atomit pyrkivät saamaan uloimman elektronikuorensa täyteen. Tällöin atomi on energeettisesti parhaassa tilassa, eli oktetissa. Atomit pyrkivät reagoimaan muiden atomien kanssa siten, että ne saisivat uloimman elektronikuorensa täyteen. Oktetti voidaan saavuttaa kahdella tapaa, joita käsitellään seuraavaksi.
Ionisidos ja ioniyhdisteet
Tarkastellaan kahta atomia: natriumia ja klooria. Natriumilla on uloimmalla elektronikuorellaan vain yksi elektroni, kun taas kloorilla on uloimmalla kuorellaan seitsemän elektronia. Molemmat atomit voivat saavuttaa oktetin siirtämällä yhtä elektronia: natrium luovuttamalla yhden elektronin ja kloori vastaanottamalla yhden elektronin. Kun kloori- ja natriumatomit pääsevät lähekkäin, natrium luovuttaa kloorille yhden elektroneistaan. Atomit siis reagoivat. Tällä tavoin molemmat atomit saavuttavat oktetin.
Elektronin luovutuksesta johtuen natriumilla on nyt yhden elektronin vajaus. Koska protonien määrä ei ole muuttunut, sillä on nyt yksi protoni enemmän kuin elektroneita. Protonit ja elektronit eivät siis enää kumoa toistensa varausta, vaan nyt natriumilla on positiivinen kokonaisvaraus, ja se merkitään Na+. Vastaavasti kloori sai yhden elektronin lisää, joten kloorilla on negatiivinen kokonaisvaraus, ja se merkitään Cl−. Kun atomin kokonaisvaraus ei ole neutraali, sitä kutsutaan ioniksi. Erimerkkiset varaukset vetävät toisiaan puoleensa, joten Na+- ja Cl−-ionit sitoutuvat toisiinsa.
Tätä yhdistettä kutsutaan natriumkloridiksi. Tämä voidaan ilmoittaa kemiallisena reaktiona seuraavasti:
Na+ + Cl− ⇒ NaCl
Tutumpi nimi natriumkloridille on ruokasuola. Kaikkia yhdisteitä, jotka muodustuvat metallin ja epämetallin välille, kutsutaan ioniyhdisteiksi, eli suoloiksi. Koska metalleja ja epämetalleja on paljon erilaisia, on myös suoloja tuhansia erilaisia.
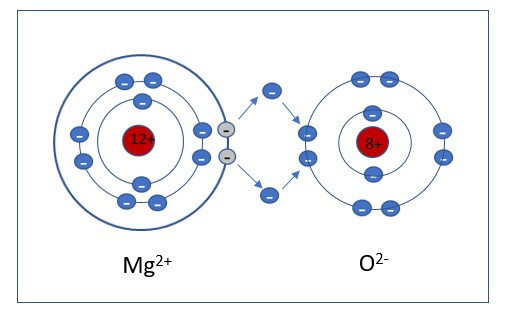
Vastaavasti esimerkiksi magnesium ja happi voivat muodostaa ioniyhdisteen. Magnesium on jaksollisessa järjestelmässä ryhmässä 2, joten se pääsee oktettiin luovuttamalla kaksi elektronia. Happi on pääryhmässä 6, eli saa oktetin ottamalla vastaan kaksi elektronia.
Ionit ja niiden muodostamat suolat
Kaikilta ensimmäisen ryhmän alkuaineet saavat oktetin luovuttamalla yhden elektronin, joten niiden ionin varaus on +1 (esimerkiksi Na+ ). Vastaavasti kaikkien toisen ryhmän alkuaineiden varaus on +2, seitsemännen pääryhmän alkuaineiden −1 ja kuudennen pääryhmän −2. Muissa ryhmissä ja monen atomin ioneissa päättely ei ole niin helppoa. Taulukossa on kuvattu yleisimmät ionit ja niiden varaus.
| Yleisimmät positiiviset ionit | Yleisimmät negatiiviset ionit | ||
|---|---|---|---|
| Kemiallinen kaava | Nimi | Kemiallinen kaava | Nimi |
| H+ | Vety | O2− | Oksidi |
| Li+ | Litium | F− | Fluoridi |
| Na+ | Natrium | Cl− | Kloridi |
| K+ | Kalium | Br− | Bromidi |
| Ca2+ | Kalsium | OH− | Hydroksidi |
| Cu2+ | Kupari | SO4 2− | Sulfaatti |
| Fe2+ | Rauta | NO3 − | Nitraatti |
| Al3+ | Alumiini | CO3 2− | Karbonaatti |
Kun negatiiviset ionit muodostavat sidoksia positiivisten ionien kanssa, ne muodostavat ioniyhdisteen. Atomien määrä riippuu ionien varauksista. Reaktiossa muodostuvan ioniyhdisteen kokonaisvaraus on aina 0, eli positiivisia ja negatiivisia varauksia on yhtä paljon, jolloin ne kumoavat toisensa. Esimerkiksi:
| Na+ + Cl− → NaCl | Varaukset +1 ja −1, joten molempia tarvitaan yksi |
| Mg2+ + O2− → MgO | Varaukset ovat +2 ja −2, joten molempia tarvitaan yksi |
| 2 Na+ + O2− → Na2O | Varaukset ovat +1 ja −2, natriumioneja tarvitaan kaksi kumoamaan hapen −2 varaus |
Mikä ioniyhdiste syntyy alumiini- ja kloridi-ionin reaktiossa? Katso ratkaisu videolta.
Taulukossa on joitain yleisimpiä ioniyhdisteitä.
| Positiivinen ioni | Negatiivinen ioni | Kemiallinen kaava | Nimi |
|---|---|---|---|
| Na+ | Cl− | NaCl | Natriumkloridi |
| Na+ | O2− | Na2 O | Natriumoksidi |
| Mg2+ | Cl− | MgCl2 | Magnesiumkloridi |
| Zn2+ | O2− | ZnO | Sinkkioksidi |
| Ca2+ | CO3 2− | CaCO3 | Kalsiumkarbonaatti |
| Cu2+ | SO4 2− | CuSO4 | Kuparisulfaatti |
Osaatko?
- Päättele jaksollisen järjestelmän avulla, mikä on seuraavien atomien muodostamien ionien varaus?
- Vety
- Beryllium (Be)
- Kalsium
- Jodi
- Rikki
- Mikä suola muodostuu seuraavien atomien ioneista?
- Litium ja kloori.
- Kalium ja happi.
- Rauta ja Bromi.