meta data for this page
Tämä on vanha versio dokumentista!
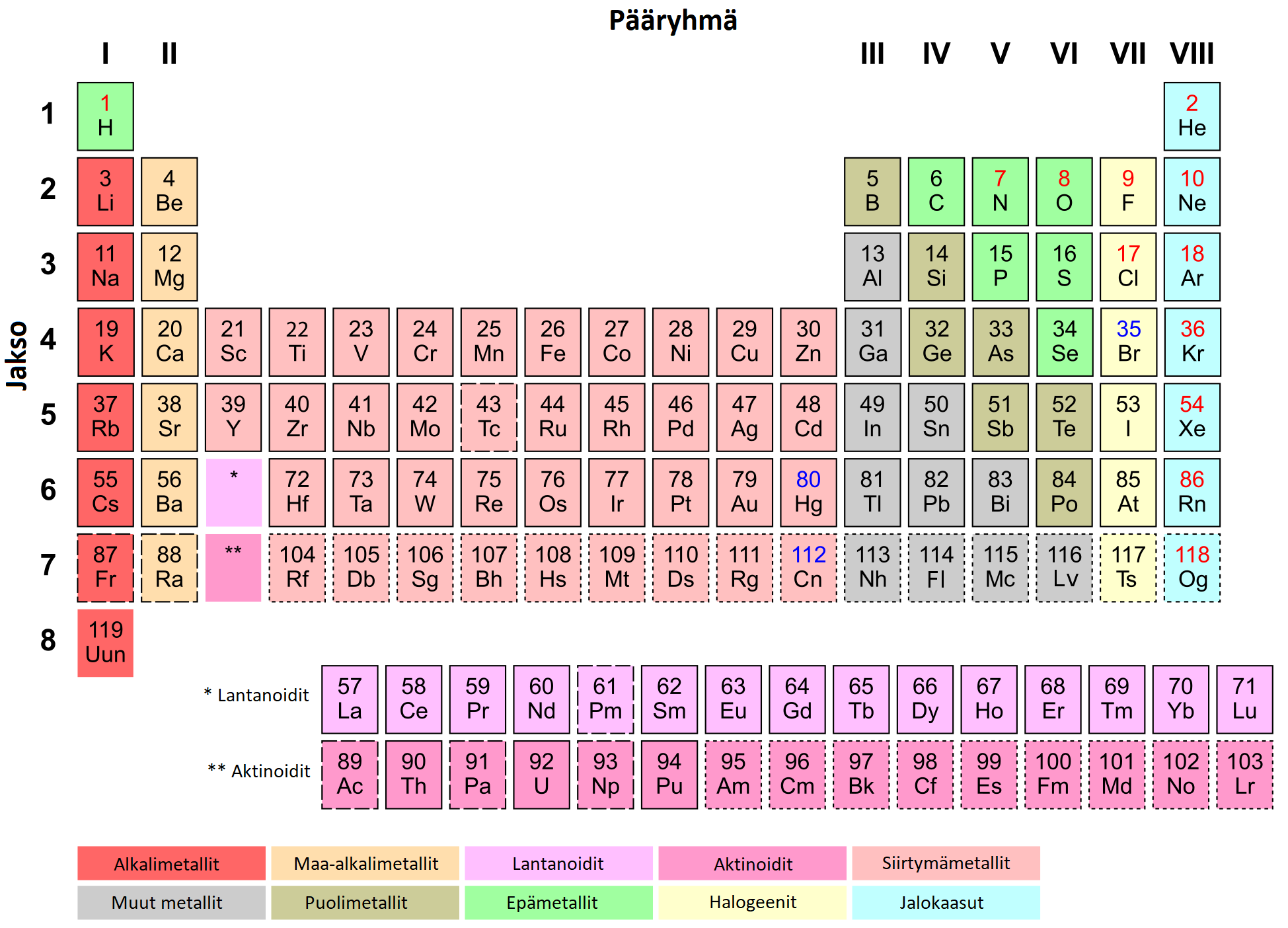
Alkuaineiden jaksollinen järjestelmä
Tiivistelmä
- Jaksollisessa järjestelmässä on lueteltu kaikki tunnetut alkuaineet
- Alkuaineet ovat jaksollisessa järjestelmässä järjestysluvun eli protoneiden lukumäärän mukaisessa järjestyksessä
- Jaksollisen järjestelmän pystyrivejä sanotaan ryhmiksi ja vaakarivejä jaksoiksi
- Ryhmä kertoo alkuaineen ulkoelektronien lukumäärän ja jakso kertoo atomin elektronikuorten lukumäärän
- Alkuaineita voidaan jaotella monella tapaa:
- Ryhmän nimen ja käyttäytymisen mukaan: alkalimetallit, maa-alkalimetallit, halogeenit, jalokaasut, jne.
- Metallit, puolimetallit ja epämetallit
- Kiinteät, nestemäiset ja kaasut
Alkuaine
Alkuaineeksi sanotaan sellaista ainetta, jossa on vain yhden tyyppisiä atomeja. Samoilla atomeilla on aina sama määrä protoneita ytimessään. Erilaisia atomeja tunnetaan noin 118 eli alkuaineita on noin 118 erilaista.
Tuttuja alkuaineita ovat mm. happi, vety, rauta, kulta ja hopea. Esimerkiksi vesi ei ole alkuaine, koska vesi sisältää sekä happi- että vetyatomeita.
Alkuaineiden jaksollisen järjestelmän synty
Jo ajanlaskun alussa (vuonna 0) tunnettiin alkuaineista noin kymmenen: rauta, kupari, hiili, sinkki, kulta, hopea, lyijy, tina ja rikki. Suurin osa alkuaineista löydettiin 1800-luvun alkupuolella. Viimeisen sada vuoden aikana jaksollinen järjestelmä on täydentynyt noin 30 alkuaineella ja näistä lähes kaikki ovat laboratoriossa valmistettuja eli niitä ei löydy luonnosta.
Eri alkuaineista huomattiin, että osa niistä reagoi keskenään samaan tapaan. Kemistit ovat pyrkineet järjestämään alkuaineita järjestykseen. Näin on syntynyt jaksollinen järjestelmä. Nykyinen jaksollinen järjestelmä Dmitri Mendelevin luoma vuodelta 1869, jolloin oli vielä paljon alkuaineita löytämättä. Vielä tuolloin löytymättömillä alkuaineille Mendelev osasi jättää tyhjän tilan jaksolliseen järjestelmään.
Jaksollinen järjestelmä
Jaksollisessa järjestelmässä alkuaineiden järjestys määräytyy atomissa olevien protoneiden lukumäärän mukaan. Jaksollisessa järjestelmässä protoneiden lukumäärä on sama kuin alkuaineen järjestysluku. Vetyatomissa on yksi protoni, joten vedyn järjestysluku on yksi. Heliumissa on kaksi protonia, joten sen järjestysluku on 2.
Jaksollisen järjestelmän vaakarivejä sanotaan jaksoiksi ja pystyrivejä ryhmiksi
Samassa jaksossa olevilla alkuaineilla on aina yhtä monta elektronikuorta käytössä. 1. jaksossa (vety ja helium) on käytössä yksi elektronikuori. Ensimmäiselle elektronikuorelle mahtuu kaksi elektronia, jonka jälkeen kuori on täynnä. Atomin perustilassa on aina yhtä monta elektronia kuin ytimessä on protoneja. Litiumilla on kolme protonia (järjestysluku 3) ja perustilallaan 3 elektronia. Litiumin kaksi elektronia sijaitsevat ensimmäisellä elektronikuorella ja toisella elektronikuorella on yksi elektroni. Litium kuuluu 2. jaksoon. Toiselle elektronikuorelle mahtuu korkeintaan kahdeksan elektronia, joten siksi jaksollisen järjestelmän toiseen jaksoon kuuluu kahdeksan alkuainetta (Li-Ne).
Saman pääryhmän alkuaineilla on yhtä monta valenssielektronia eli yhtä monta elektronia uloimmalla kuorellaan. Valenssielektronit määräävät, miten alkuaine käyttäytyy kemiallisissa reaktioissa. Esimerkiksi ensimmäiseen ryhmään kuuluvat litium, natrium, kalium, rubidium, cesium ja frankium reagoivat erittäin kiivaasti veden kanssa. Myös vety lasketaan usein ensimmäisen ryhmän alkuaineeksi, mutta se on poikkeuksellinen näihin muihin nähden. Muut ensimmäisen ryhmän alkuaineet ovat metalleja, mutta vety on kaasu.
Jaksollisen järjestelmän ryhmien nimet
Jaksollisen järjestelmän ryhmiä kutsutaan joko ryhmiksi (Ryhmät 1-18), tai pääryhmiksi (Pääryhmät 1-8 eli ryhmät 1, 2, 13-18) ja sivuryhmiksi (ryhmät 3-12). Pääryhmille on annettu lisäksi omat triviaalinimet: alkalimetallit, maa-alkalimetallit, booriryhmä, hiiliryhmä, typpiryhmä, happiryhmä, halogeenit ja jalokaasut.
Alkalimetallit reagoivat kiivaasti veden kanssa. Myös maa-alkalimetallit reagoivat veden kanssa, mutta eivät yhtä kiivaasti kuin alkalimetallit. Halogeenit esiintyvät luonnossa kaksiatomisina kaasuina (eli esim. kaksi klooriatomia on aina liittyneenä yhteen) ja toisaalta muodostavat ionisidoksellisia yhdisteitä alkali- ja maa-alkalimetallien kanssa. Jalokaasut eivät ole reaktiivisia, koska niiden uloin elektronikuori on täynnä.
Metallit, epämetallit ja puolimetallit
Alkuaineet jaetaan käyttäytymisensä perusteella metalleihin ja epämetalleihin. Metallien ja epämetallien välissä sijaitsevat puolimetallit. Metallit sijaitsevat jaksollisessa järjestelmässä oikealla ja alhaalla. Epämetallit sijaitsevat jaksollisen järjestelmän oikeassa yläreunassa. Lisäksi vety on epämetalli. Puolimetallit sijaitsevat metallien ja epämetallien välissä. Puolimetalleista tärkein on pii (järjestysluku 14). Muita puolimetalleja ovat boori, germanium, arseeni, seleeni, astatiini, telluuri ja polonium.
Huoneenlämpötilassa kaikki metallit ovat kiinteitä, lukuunottamatta elohopeaa (järjestysluku 80), joka on neste. Elohopean lisäksi huoneenlämpötilassa nestemäisenä on boori. Vety, typpi, happi, fluori, kloori ja jalokaasut ovat huoneenlämpötilassa kaasuja. Yllä olevassa jaksollisessa järjestelmässä kiinteät alkuaineet on merkitty mustalla järjestysluvulla, nestemäiset on merkitty sinisellä ja kaasut punaisella järjestysluvulla.