meta data for this page
Tämä on vanha versio dokumentista!
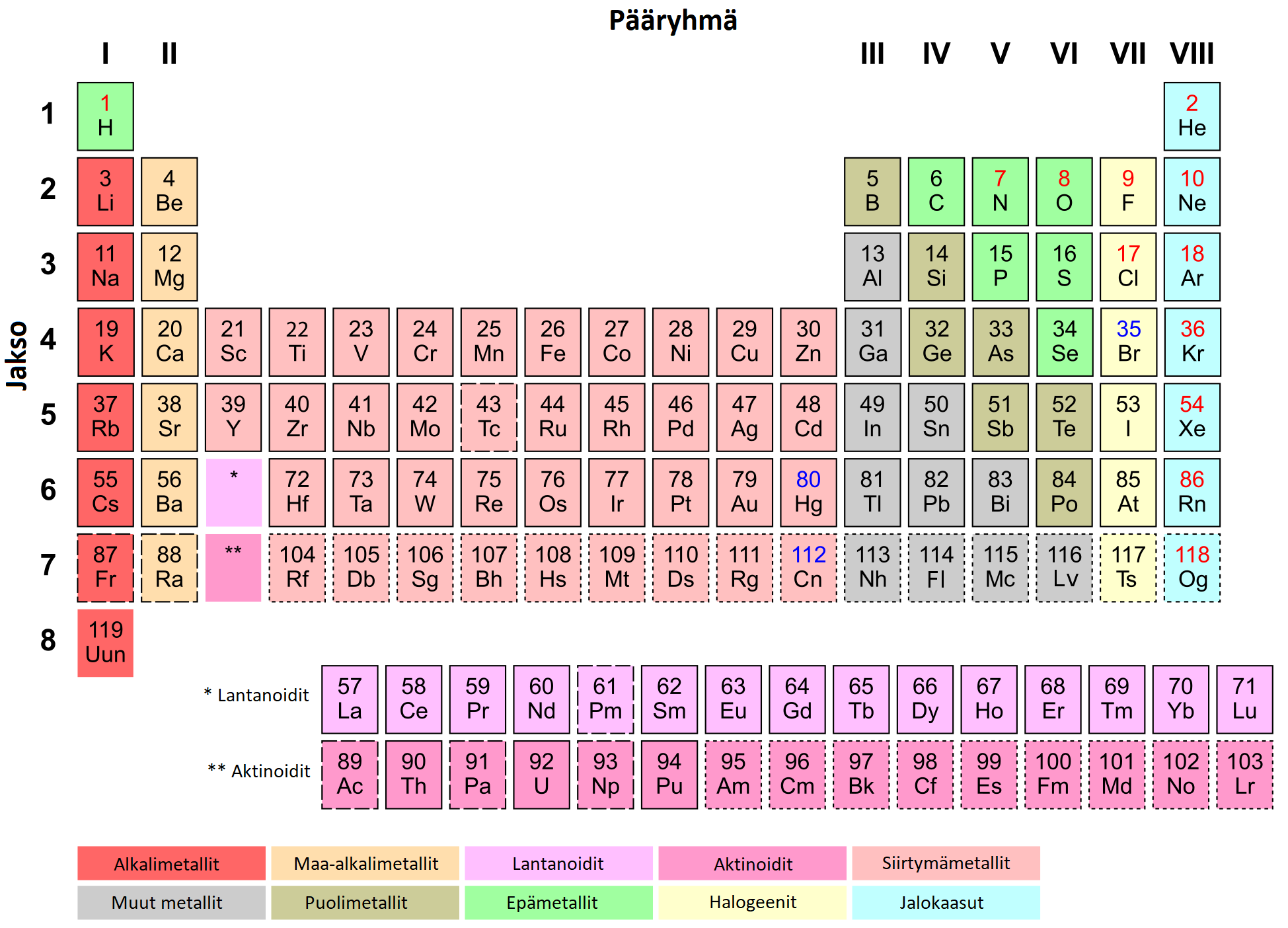
Alkuaineiden jaksollinen järjestelmä
Tiivistelmä
- Jaksollisessa järjestelmässä on lueteltu kaikki tunnetut alkuaineet
- Alkuaineet ovat jaksollisessa järjestelmässä järjestysluvun eli protoneiden lukumäärän mukaisessa järjestyksessä
- Jaksollisen järjestelmän pystyrivejä sanotaan ryhmiksi ja vaakarivejä jaksoiksi
- Ryhmä kertoo alkuaineen ulkoelektronien lukumäärän ja jakso kertoo atomin elektronikuorten lukumäärän
- Alkuaineita voidaan jaotella monella tapaa:
- Ryhmän nimen ja käyttäytymisen mukaan: alkalimetallit, maa-alkalimetallit, halogeenit, jalokaasut, jne.
- Metallit, epämetallit ja puolimetallit
- Kiinteät, nesteet ja kaasut (huoneenlämmössä)
Alkuaineiden jaksollisen järjestelmän synty
2000 vuotta sitten tunnettiin alkuaineista vasta noin kymmenen: rauta, kupari, hiili, sinkki, kulta, hopea, lyijy, tina ja rikki. Suurin osa alkuaineista löydettiin 1800-luvun alkupuolella. 1900-luvulla jaksollinen järjestelmä täydentyi noin 30 alkuaineella ja näistä lähes kaikki ovat laboratoriossa valmistettuja, eli niitä ei esiinny luonnossa.
Moni alkuaineista ovat keskenään melko samanlaisia. Alkuaineita alettiinkin 1800-luvulla järjestää ominaisuuksien mukaisesti järjestykseen. Tätä varten on syntynyt alkuaineiden jaksollinen järjestelmä. Nykyinen jaksollinen järjestelmä on Dmitri Mendelevin luoma vuodelta 1869, jolloin oli vielä paljon alkuaineita löytämättä. Vielä tuolloin löytymättömillä alkuaineille Mendelev osasi jättää tyhjän tilan jaksolliseen järjestelmään.
Jaksollinen järjestelmä
Jaksollisessa järjestelmässä alkuaineet on laitettu järjestykseen protonien määrän mukana. Järjestysluvulla tarkoitetaankin protonien määrää alkuaineen atomeissa. Esimerkiksi vetyatomissa on yksi protoni, joten vedyn järjestysluku on yksi. Heliumissa on kaksi protonia, joten sen järjestysluku on kaksi, ja niin edelleen.
Jaksollisen järjestelmän vaakarivejä sanotaan jaksoiksi ja pystyrivejä ryhmiksi
Samassa jaksossa olevilla alkuaineilla on aina yhtä monta elektronikuorta käytössä. 1. jaksossa (vety ja helium) on käytössä yksi elektronikuori. Ensimmäiselle elektronikuorelle mahtuu kaksi elektronia, jonka jälkeen kuori on täynnä. Atomin perustilassa on aina yhtä monta elektronia kuin ytimessä on protoneja. Litiumilla on kolme protonia (järjestysluku 3) ja perustilallaan 3 elektronia. Litiumin kaksi elektronia sijaitsevat ensimmäisellä elektronikuorella ja toisella elektronikuorella on yksi elektroni. Litium kuuluu 2. jaksoon. Toiselle elektronikuorelle mahtuu korkeintaan kahdeksan elektronia, joten siksi jaksollisen järjestelmän toiseen jaksoon kuuluu kahdeksan alkuainetta (Li-Ne).
Saman pääryhmän alkuaineilla on yhtä monta ulkoelektronia. Ulkoelektronit määräävät, miten alkuaine käyttäytyy kemiallisissa reaktioissa. Esimerkiksi ensimmäiseen ryhmään kuuluvat litium, natrium, kalium, rubidium, cesium ja frankium reagoivat erittäin kiivaasti veden kanssa. Myös vety lasketaan usein ensimmäisen ryhmän alkuaineeksi, vaikka se eroaa monella tapaa muista ensimmäisen ryhmän alkuaineista. Muut ensimmäisen ryhmän alkuaineet ovat metalleja, mutta vety on kaasu.
Jaksollisen järjestelmän ryhmien nimet
Jaksollisen järjestelmän ryhmiä kutsutaan joko ryhmiksi (Ryhmät 1-18), tai pääryhmiksi (Pääryhmät 1-8 eli ryhmät 1, 2, 13-18) ja sivuryhmiksi (ryhmät 3-12). Pääryhmille on annettu lisäksi omat triviaalinimet: alkalimetallit, maa-alkalimetallit, booriryhmä, hiiliryhmä, typpiryhmä, happiryhmä, halogeenit ja jalokaasut.
Alkalimetallit reagoivat kiivaasti veden kanssa. Myös maa-alkalimetallit reagoivat veden kanssa, mutta eivät yhtä kiivaasti kuin alkalimetallit. Halogeenit esiintyvät luonnossa kaksiatomisina kaasuina (eli esim. kaksi klooriatomia on aina liittyneenä yhteen) ja toisaalta muodostavat ionisidoksellisia yhdisteitä alkali- ja maa-alkalimetallien kanssa. Jalokaasut eivät ole reaktiivisia, koska niiden uloin elektronikuori on täynnä.
Metallit, epämetallit ja puolimetallit
Alkuaineet jaetaan käyttäytymisensä perusteella metalleihin ja epämetalleihin. Metallien ja epämetallien välissä sijaitsevat puolimetallit. Metallit sijaitsevat jaksollisessa järjestelmässä oikealla ja alhaalla. Epämetallit sijaitsevat jaksollisen järjestelmän oikeassa yläreunassa. Lisäksi vety on epämetalli. Puolimetallit sijaitsevat metallien ja epämetallien välissä. Puolimetalleista tärkein on pii (järjestysluku 14). Muita puolimetalleja ovat boori, germanium, arseeni, seleeni, astatiini, telluuri ja polonium.
Huoneenlämpötilassa kaikki metallit ovat kiinteitä, lukuunottamatta elohopeaa (järjestysluku 80), joka on neste. Elohopean lisäksi huoneenlämpötilassa nestemäisenä on boori. Vety, typpi, happi, fluori, kloori ja jalokaasut ovat huoneenlämpötilassa kaasuja. Yllä olevassa jaksollisessa järjestelmässä kiinteät alkuaineet on merkitty mustalla järjestysluvulla, nestemäiset on merkitty sinisellä ja kaasut punaisella järjestysluvulla.