meta data for this page
Tämä on vanha versio dokumentista!
Atomi
Jos pientä hiekanjyvää puolittaisi loputtomasti, jäljelle jäisi lopulta yksi pieni hiukkanen, jota ei pysty enää puolittamaan. Tämä hiukkanen on kaiken aineen rakennuspalanen, ja sitä kutsutaan atomiksi. Pienessä hiekanjyvässäkin on valtava määrä atomeita. Kaikki aine, niin ilmassa olevat kaasut, kasvit kuin myös sinä, koostuu atomeista. Vaikka ihminen tuntee miljoonia erilaisia aineita, erilaisia atomeja tunnetaan tällä hetkellä ainoastaan 118 ja niistäkään kaikkia ei esiinny luonnossa.
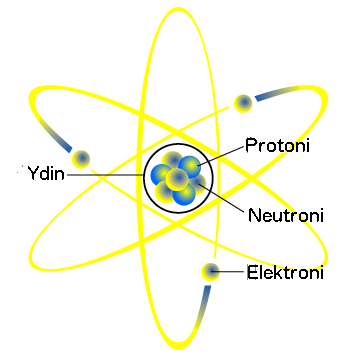
Atomin rakenne
Vaikka atomi on hyvin pieni hiukkanen, sen keskellä on vielä atomin kokoonkin nähden hyvin pieni ydin. Ytimessä on kahta erilaista hiukkasta: protoneita ja neutroneita. Näistä protonit ovat tärkeämpiä, sillä protonien määrä ratkaisee, minkä alkuaineen atomista on kyse. Esimerkiksi kaikille vety-atomeilla on ytimessään vain yksi protoni, kun taas kaikilla rauta-atomeilla protoneita on 26. Neutronien määrä vaihtelee samankin aineen kesken, mutta niitä on useimmiten suunnilleen yhtä paljon kuin protoneitakin. Protonit ja neutronit ovat pakkautuneet hyvin lähelle toisiaan atomin keskelle.
Atomin ydintä kiertää elektronit. Elektronit kiertävät ydintä epäsäännöllisellä etäisyydellä ja nopeudella elektroniverhoksi nimetyllä alueella. Elektroneita on atomeilla yleensä sama määrä kuin protoneitakin: esimerkiksi vedyllä elektroneita on yksi ja raudalla 26, sillä myös protoneita on yhtä monta. Kaikki elektronit eivät kuitenkaan ole samalla etäisyydellä.
Atomiytimen ympärillä sijaitsee protoneihin nähden sama määrä elektroneja (e−), joiden todennäköistä sijaintia kuvastaa teoreettinen todennäköisyysjakauma. Elektronit eivät kulje ympyräradalla, eikä edes jatkuvaa käyrää pitkin, niillä ei ole määriteltyä kulmanopeutta, eikä hetkellistä nopeutta. Elektroni ei sanan varsinaisessa merkityksessä siten ”liiku” tai ”kierrä” lainkaan vaan ”on olemassa” tietyssä pisteessä tietyllä hetkellä, todennäköisyydellä ja etäisyydellä atomiytimestä.[3]
Saman alkuaineen kaikissa atomeissa on yhtä monta protonia. Protonien lukumäärä on samalla alkuaineen järjestysluku jaksollisessa järjestelmässä. Saman alkuaineen atomeilla voi kuitenkin olla eri määrä neutroneja ja sen mukaisesti eri massaluku. Tällä tavalla toisistaan eroavia atomeja sanotaan alkuaineen eri isotoopeiksi. Saman alkuaineen eri isotooppien kemialliset ominaisuudet ovat samanlaisia, mutta ne voivat erota esimerkiksi radioaktiivisuutensa puolesta.
Atomin ydin määrää siis alkuaineen, mutta elektroniverho sen, millaisia ioneja ja yhdisteitä voi syntyä. Elektroniverhossa ovat mahdollisia vain tietyt muutokset, jotka määräytyvät elektronien energiatilan mukaan. Kaikista vakaimmat ja vähiten reagoivat alkuaineet ovat jalokaasut, koska niillä on 8 elektronia uloimmalla kuorellaan, eli ne ovat oktetissa.
Elektronit jakaantuvat eri pääkvanttitasoille eli elektronikuorille. Ytimestä ulospäin tasot ovat joko 1, 2, 3, 4, 5, 6 ja 7 tai vaihtoehtoisesti K-, L-, M-, N-, O-, P- ja Q-tasot. Elektroneja mahtuu ensimmäiselle eli K-tasolle vain kaksi kappaletta. Toiselle energiatasolle mahtuu 8 elektronia, kolmannelle tasolle 18 kappaletta, neljännelle 32 kappaletta, viidennelle 50 kappaletta, kuudennelle 72 kappaletta ja seitsemännelle 98 kappaletta. Q-taso on ytimestä katsottuna etäisin, jossa minkään nykyisin tunnetun alkuaineen atomilla on perustilassa elektroneja. Elektronien maksimilukumäärä yhdellä energiatasolla voidaan laskea yksinkertaisella laskutoimituksella 2 · n², missä ’n’ korvataan tason järjestysluvulla. Näin teoreettisesti kuvitteelliselle kahdeksannelle tasolle mahtuvat elektronit lasketaan 2 · 8² = 128, eli kahdeksannelle tasolle mahtuisi teoriassa 128 elektronia.
Ioneja muodostuu, kun atomi tai kemiallinen yhdiste luovuttaa tai ottaa vastaan yhden tai useamman elektronin.

